Metalle:
- hohe elektrische Leitfähigkeit, d.h. gute elektrische Leiter
- hohe thermische Leitfähigkeit
- hohes Reflexionsvermögen für Licht
- platisch verformbar, auch bei tiefen Temperaturen
- chemisch häufig nicht sehr beständig
- Teils ferromagnetisch
Einteilung der Metall in Leicht und Schwermetalle
- Leichtmetalle (Gewicht bis ca. 5g/cm^3)
- Aluminium
- Magnesium
- Titan
- Schwermetall Niedrigschmelzende (Gewicht über 5g/cm^3)
- Zinn > Sn
- Blei > Pb
- Zink > Zn
- Schwermetall Hochschmelzende (Gewicht über 5g/cm^3)
- Eisen > Fe
- Chrom > Cr
- Kuper > Cu
Chemische Bindung:
- Atome versuchen stabile Konfiguration zu erreichen, z.B. Edelgaskonfiguration
- gehen chemische Bindungen ein
unterschiedliche Grenztypen der chemischen Bindung:
- Ionenbindung
- Atombindung
- Metallische Bindung
- Van-der-Waals-Bindung
- Wasserstoffbrückenbindung
Für alle Arten der chemischen Bindung gilt:
- die Elektronen sind für die chemischen Bindung verantwortlich
- die Elektronenkonfiguration der in Verbindung tretenden Atome bestimmt die Art der chemischen Bindung
- An der chemischen Bindung sind nur die Valenzelektronen (äußere Elektronen) der Atome beteiligt
Mischkristalle:
Substitutionsmischkristalle:
- Frematome lagern sich auf Gitterplätzen des Wirtsgitter an
- Gute Löslichkeit durch Substitution ist zu erwarten, wenn die Atome der beteiligten Elemente (A und B) etwa gleich sind, und die reinen Elemente gleiche Gitterstruktur besitzen
- Löslichkeit im Zwischengitter erfordert kleine Fremdatome (meist Nichtmetalle wie H, N, S, O...)
- Gelöste Komponente (~n) wird (werden) auf Gitterplätze des Wirtsgitters eingebaut
Bsp.
- Ag/Au,Cu/ Au, Ni/Au
- Wirtskomponente und gelöste Komponente im gleichen Gittertyp
- Atomradien +- 15%
Substitutionsatom im Kreiverbund und die Dimension des Gitteraufbaufehlers:
Skizzieren Sie eine Stufen-Versetzung:
Definieren Sie den Begriff Packungsdichte:
- Ist das Verhältnis zwischen Volumen der Elementarzelle und Volumen beteiligter Atome
- Atome > harte Kugeln gleicher größe
Definieren Sie den Begriff Elementarzelle:
- Ist die kleinste Einheit eines Kristallgitters, die alle Eigenschaften des gesamten Gitters aufweist
- Zelle mit kleinstmöglichen Volumen, die durch Anwendung aller möglichen Translationsoperationen den gesamten Raum ausfüllt
Ermittlung der Anzahl der Atome pro Elementarzelle:
wie gerechnet wird:
8 x 1/8 + 1 = 2
3 Beispiele die das krz aufweisen:
- alpha-Ferrit
- Cr
- Mo
wie es gerechnet wird:
8 x 1/8 + 6 x 1/2 = 4
Erklären Sie den Begriff Allotropie am Beispiel von Eisen:
Allotropie: Werkstoff kann bei Temperaturwechel umkristallieren, er ist also in verschiedenen Modifikationen stabil.
z.B. Eisen:
- bis 911°C krz
- bis 1392°C kfz
- ab 1392°C krz
Erklären Sie den Begriff Anisotropie:
Man nennt einen Körper anisotrop, wenn seine Eigenschaften von der Richtung abhängig ist, in der sie gemessen werden. Liegt keine Änderung der Eigenschaften in Abhängigkeit der Richtung vor, so ist ein Körper isotrop. In Kristallen sind Atomabstände in einer Richtung gleich, in verschiedenen Richtungen verschieden. Als Konsequenz dieser geometrischen Anisotropie folgt in erster Näherung die Richtungsabhängigkeit der Kristalleigenschaften.
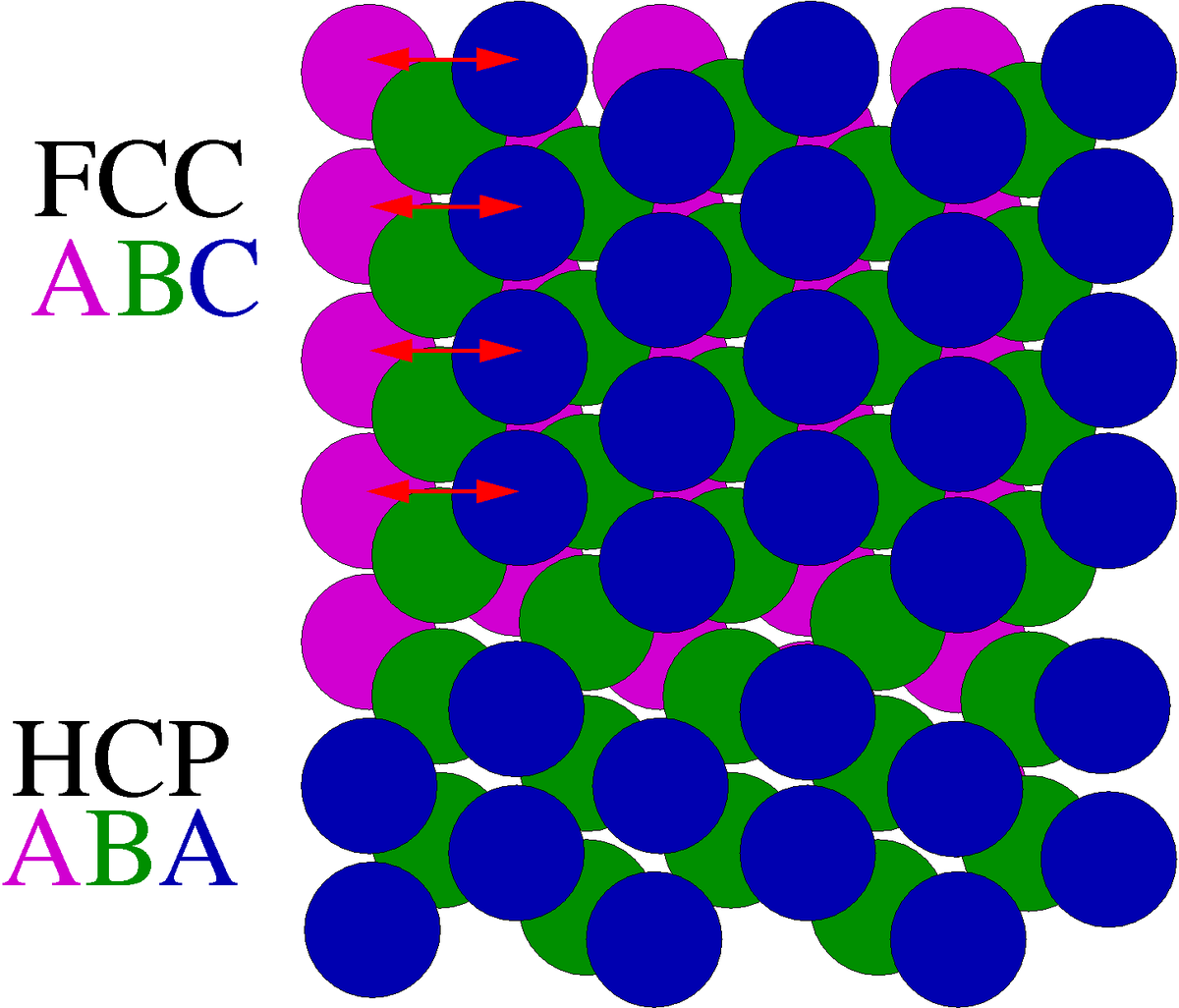
Skizzieren Sie einen Stapelfehler und welche Dimension hat dieser Fehler?
Ein Stapelfehler ist ein 2-dimensionaler Gitterfehler






Keine Kommentare:
Kommentar veröffentlichen